Il Sars-CoV-2 penetra nelle nostre cellule anche attraverso un'altra porta di ingresso. È la scoperta a cui è arrivato un gruppo di ricercatori internazionali, guidati dall'Università di Bristol che, studiando il virus che provoca il Covid-19, ha evidenziato il ruolo della Neuropilina-1 (NRP1), una proteina presente sulla superficie delle cellule di diversi tessuti.
"La Neuropilina-1 è una proteina fondamentale espressa sulla superficie delle nostre cellule, che funge da recettore per svariate proteine che circolano nel nostro corpo- ha spiegato al Giornale.it Boris Simonetti, il ricercatore italiano che ha contribuito alla scoperta- Queste proteine contengono una specifica sequenza di amminoacidi che agisce come una sorta di codice a barre per il riconoscimento da parte della Neuropilina-1 che ne permette l’internalizzazione nelle cellule". Studiando il Sars-CoV-2, i ricercatori hanno notato somiglianze tra la proteina Spike, usata dal nuovo coronavirus per penetrare nelle cellule, e quelle che solitamente si legano alla NRP1. "Insieme ai colleghi del laboratorio del Prof. Cullen e il virologo Dr. Yamauchi, abbiamo notato che la proteina Spike del Sars-CoV-2 ha una sequenza di amminoacidi molto simile a quella delle proteine che nel nostro corpo si legano alla Neuropilina-1- ha aggiunto Simonetti- Questo ci ha fatto ipotizzare che anche il virus potesse sfruttare questo recettore per entrare nelle nostre cellule".
Sappiamo che, per entrare nelle cellule del corpo umano, il Sars-CoV-2 utilizza la proteina Spike, che si lega al recettore ACE2. Lo studio, però, dimostra la presenza di un'altra via di ingresso, attraverso la NRP1, che potrebbe spiegare anche il motivo per cui il virus è così infettivo e capace di riprodursi velocemente nelle cellule umane: "NRP1 migliora l'ingresso e l'infezione da Sars-CoV-2", affermano i ricercatori nello studio. La scoperta, spiegano gli scienziati, "potrebbe aver identificato che cosa rende il virus Sars-CoV-2 così infettivo e capace di diffondersi rapidamente nelle cellule umane".
Una volta compreso il ruolo della Neuropilina-1, gli scienziati si sono concentrati sulla struttura del legame che si crea tra le due proteine: "Utilizzando varie tecniche biochimiche siamo riusciti a stabilire che la proteina Spike si lega alla Neuropilina-1 e abbiamo ottenuto anche la struttura delle due proteine insieme in collaborazione con il Prof. Brett Collins presso l’Università del Queensland", racconta Simonetti. La ricostruzione ha mostrato che una parte della Spike riesce a inserirsi in una cavità della NRP:"Per fare un’analogia, questa interazione sembra una mano tesa da parte della NRP1 che viene afferrata dalla proteina Spike per promuovere l’ingresso del virus nelle cellule".
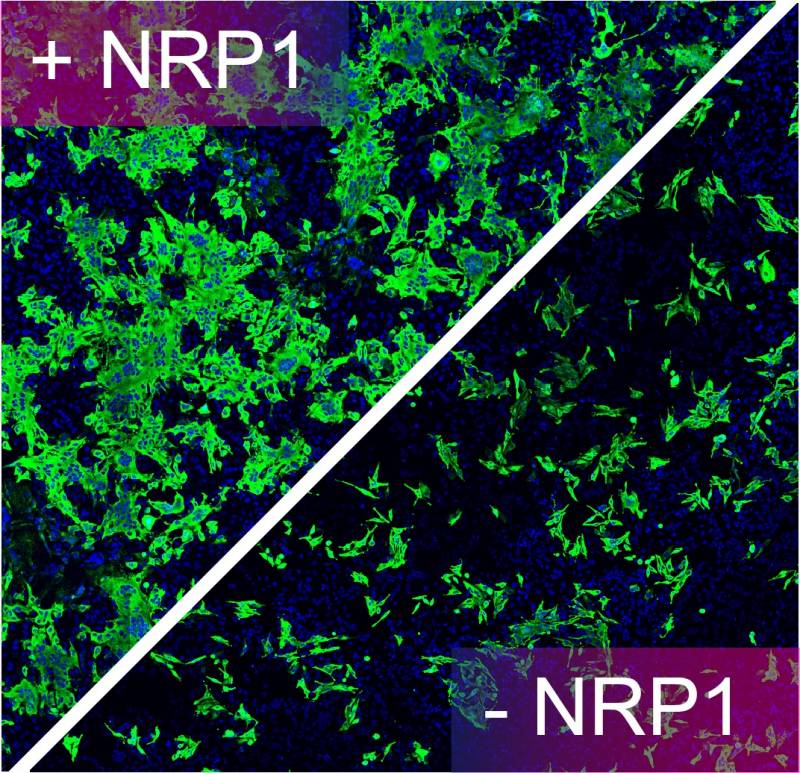
Dopo aver stabilito il modo in cui la proteina Spike può legarsi alla Neuropilina-1, i ricercatori hanno notato che "l'interazione serve a migliorare l'invasione di Sars-CoV-2 nelle cellule umane coltivate in colture cellulari". Ma, usando anticorpi monoclonali (cioè proteine generate in laboratorio, che sembrano anticorpi) e una molecola specifica, è possibile ridurre l'infezione di Sars-CoV-2. "Abbiamo dimostrato che è possibile ridurre l’infezione del Sars-CoV-2 in colture cellulari cresciute in laboratorio colpendo l’interazione tra le proteine Spike e NRP1 con un anticorpo monoclonale o una piccola molecola, che previene l'associazione tra Spike e questo recettore", afferma Simonetti che, per spiegare meglio il meccanismo usa nuovamente l'immagine della mano: "Questi approcci bloccano la mano tesa della Neuropilina-1 così che la Spike non possa afferrarla". In questo modo, la diffusione del virus viene ridotta, come mostra l'immagine seguente, in cui sono state evidenziate in verde le cellule infettate: la rimozione della NRP1 riduce l'infezione nelle cellule in coltura. lo stesso risultato si ha se si usano l'anticorpo o la molecola che colpiscono la proteina.
"Si può quindi avanzare l’ipotesi che delle molecole contro questo sito di legame possano essere utilizzate per prevenire che la proteina Spike sfrutti la NRP1 per entrare nelle cellule, e quindi ridurre l’infezione- conclude Simonetti- Ma è importante sottolineare che nel nostro studio questi approcci anti-Neuropilina-1 sono stati testati in colture cellulari in laboratorio". Per questo, saranno necessarie ulteriori ricerche, "per stabilire se l’interazione tra la Spike e la Neuropilina-1 è un meccanismo con applicazioni terapeutiche per Covid-19".
A conclusioni simili sul ruolo della Neuropilina-1 era arrivato, in modo indipendente, anche un altro team di ricercatori dell'Università Tecnica di Monaco e Helsinki, che ha osservato la composizione di Sars-CoV-2, identificando una catena di amminoacidi che permetteva alla proteina Spike di legarsi, oltre che con ACE2, anche con NRP1. "Se i recettori sono entrambi presenti come avviene in alcune cellule delle vie respiratorie- aveva spiegato il team- la potenza infettiva del coronavirus si esprime al massimo grado". La scoperta di entrambi i gruppi di ricercatori era già stata resa nota lo scorso settembre, ma si trattava di studi ancora in attesa di verifiche. Ora, i due studi sono stati pubblicati sulla rivista Science, dopo essere stati verificati.
"Questi risultati- concludono i ricercatori di Bristol- evidenziano l’importanza che questa scoperta potrebbe avere per lo sviluppo di nuove terapie per la lotta contro il COVID-19".
